Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut TERMOKIMIA. Secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan kalor yang menyertai reaksi kimia, perubahan keadaan, dan pembentukan larutan.
Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
1. Hukum kekekalan energi
Tujuan utama termodinamika kimia ialah pembentukan krieteria untuk ketentuan penentuan kemungkinan terjadi atau ketentuan penentuan kemungkinan terjadi atau spontanitas dari trasformas digunakan memperkirakan perubahan energi yang terjadi dalam proses-proses berikut:
a. Reaksi kimia
b. Perubahan fase
c. Pembentukan larutan
Hukum Termodinamika I
Sebagian besar ciri-ciri dalam termokimia berkembang dari penerapan hukum termodinamika I, atau Hukum Kekekalan Energi, dialah Wilard Gibs, pendiri Termodinamika Pertama.
Bunyi Hukum Kekekalan Energi
Energi tidak dapat diciptakan, dimusnahkan, hanya dapat berubah bentuk dari satu bentuk ke bentuk lainnya
Energi
Energi apa yang dimiliki setiap zat?
Energi = kapasitas atau kemampuan untuk melakukan kerja
Menurut teori kinetik, baik zat berwujud padat, cair dan gas pada suhu 0 Kelvin terdiri banyak partikel-partikel kecil berupa molekul-molekul atau atom-atom yang terus bergerak secara acak dan beranekaragam yang saling brtumbukan dan berpantulan.
Setiap gerakan, dipengaruhi oleh banyak faktor dan dapat berubah bentuk saling bertumbukan. Hal ini menyebabkan energi gerakan satu partikel akan berbeda dengan yang lain. Jumlah total semua partikel dalam sistem disebut energi dalam (U)
Energi = fungsi keadaan (bergantung pada keadaan sistem)
Termokimia hanya berkepentingan pada perubahan energi dalam ∆U
Kerja
Kerja adalah pertukaran energi antara sistem dan lingkungan selain dalam bentuk kalor (w).
W = gaya x jarak = P x A x h
P x h = perubahan volume
Maka: W = P x ∆V
Jika tekanan dinyatakan dalam atm dan volume dalam liter maka satuan kerja adalah liter atm. 1Latm = 101,32 J
Kalor
Kalor adalah energi yang berpindah dai sistem ke lingkungan atau sebaliknya karena perbedaan suhu, yaitu suhu yang lebih tinggi ke suhu yang lebbih rendah.
1kal = 4,148 J
Rumus menghitung kalor :
atau
Q = C.∆T
Kalorimeter Bom
Penentuan kalor reaksi pada volume tetap ditentukan dengan menggunakan bom kalorimeter, harga kalor yang diperoleh merupakan harga ∆U
1. Entalpi dan Perubahan Entalpi
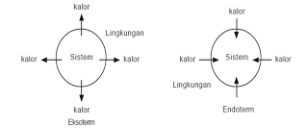
a. Sistem dan Lingkungan
Sistem adalah sesuatu yang menjadi pusat perhatian kota dalam hal ini adalah peroses kimia yang terjadi
Lingkungan adalah sesuatu yang berada diluar sistem
Sebagai Contoh :
Gelas kimia yang berisi air dan es. Yang merupakan sistem adalah es batu yang sedang mencair dan yang menjadi lingkungannya air, gelas kimia, dan udara sekitar.
Berdasarkan kemampuan untuk melakukan pertukaran, maka sistem dikelompokkan menjadi tiga yaitu :
- sistem terbuka
- sistem tertutup
- sistem terisolasi
b. Reaksi Eksoterm dan Endoterm
1. Reaksi Eksoterm
· Reaksi yang membebaskan kalor
· Suhu sistem > suhu lingkungan
· Kalor berpindah dari sistem ke lingkungan
· Disertai kenaikan suhu
· Penulisan persamaan reaksinya :
A + B → C dibebaskan kalor 10 kj (misalnya)
A + B → C +10kj (dibebaskan kalor)
Reaktan = produk +10kj
r > p
∆H = Hp – Hr
Kecil – Besar
∆H = – (negatif)
2. Reaksi Endoterm
· Reaksi yang memerlukan kalor
· Suhu sistem < suhu lingkungan
· Kalor berpindah dari lingkungan kesistem
· Disertai penurunan suhu
· Penulisan persamaan reaksinya :
A + B +25kj → C
A + B → C -25kj
r = p-25kj
r < p
∆H = Hp– Hr
Besar – Kecil
∆H = positif (+)
a. Energi dan Entalpi
Alam semesta ciptaan Tuhan memiliki energi yang konstan. Berdasarkan asas kekekalan energi yang tidak dapat diciptakan atau memusnahkan energi. Yang dapat kita lakukan hanyalah mengubah suatu bentuk energi menjdi bentuk energi yang lain. Di alam ini banyak sekali terjadi berbagai energi, contohnya energi kinetik, potensial, mekanik dan lain sebagainnya.
Jumlah total semua bentuk enegi tersebut inilah dapat kita sebut sebagai Entalpi (H), yang artinya jumlah energi yang terkandung atau tersimpan dalam suatu zat pada suhu 298 k ( 250C). Istilah ini diambil dari bahasa Jerman, Entalphien yang artinya kandungan yang diusulkan oleh Herman Helmholtz.
b. Perubahan Entalpi
Kita asumsikan sebuah mobil yang bergerak dari satu titik tertentu ke titik yang lain dimana dalam menentukan berapa besar energi yang dikeluarkan oleh mobil dilihat dari besarnya perubahan energinya mobil tersebut berpindah tempat. Begitu pula dengan entalpi dimana dalam menentukannya dilihat dari besarnya perubahan entalpi yang terjadi.
∆H = H2 – H1
Begitu juga dengan proses kimia, bahwa perubahan entalpi terjadi bila sistem melepas atau menyerap kalor. Dalam reaksi dituliskan dalam :
A + B → AB
Reaktan Produk
∆H = Hp – Hr
Jenis perubahan entalpi
Perubahan entalpi pembentukan (∆Hf)
Perubahan entalpi penguraian (∆Hd)
Perubahan entalpi pembakaran (∆Hc)
Perubahan entalpi penetralan (∆Hnet)
Perubahan Entalpi Pembentukan (∆Hf)
Perubahan entalpi pembentukan pada 1 mol senyawa dari unsurnya.
Contohnya : C + O2 → CO2
∆Hf → f = formation = pembentukan
Unsur + Unsur → Senyawa
Misal :
C + 2H2 + ½ O2 → CH3OH = – 200 kJ
∆H0f = ∑ n∆H0 f produk – ∑ n∆H0 f reaktan
Contoh Soal :
Tentukanlah perubahan entalpi reaksi berikut :
C2H4(g) + H2O(l) → C2H3OH(l)
Jika diketahui masing-masing ∆H0f C2H3OH(l) = -277,7 kJ/mol, ∆H0f C2H4(g) = + 523 kJ/mol dan ∆H0f H2O(l) = – 285,8 kJ/mol…
Jawab :
Mari kita lihat ciri soal yang diketahui adalah data entalpi dari masing-masing senyawa yang bereaksi, lalu kita ketahui bahwa yang menjadi produk ialah C2H3OH, sedangkan yang menjadi reaktannya ialah C2H4(g) + H2O(l)
Maka,
∆H0f = ∑ n∆H0 f produk – ∑ n∆H0 f reaktan
∆H0f = -277,7 kJ/mol – (+ 523 kJ/mol + – 285,8 kJ/mol)
= -277,7 kJ/mol – 237, 2 kJ/mol
= -514,9 kJ/mol
Perubahan Entalpi Penguraian ∆Hd
Perubahan entalpi penguraian pada 1 mol senyawa dari unsurnya.
Contoh : CO2 → C + O2
∆Hd → d = decomposition = penguraian
Senyawa → Unsur + Unsur
Misal : CO2(g) → C(g) + O2(g) ∆H = 393,5 kJ
Perubahan Entalpi Pembakaran ∆Hc
Perubahan entalpi pembekaran pada 1 mol senyawa dari unsurnya.
∆Hc → c = combustion = pembakaran
½ O2
Misal : C + ½ O2 → CO → CO2
Entalpi Netralisasi ∆Hnet
∆H yang dihasilkan (selalu eksoterm) pada reaksi penetralan asam atau basa.
Contoh:
NaOH(aq) + HCl(aq) à NaCl(aq) + H2O(l) ∆H = -890,4 kJ/mol
c. Persamaan Termokimia
Persamaan yang menggambarkan suatu reaksi yang disertai informasi tentang perubahan entalpi (kalor). Oleh karena entalpi merupakan sifat ekstensif (nilainya bergantung pada besar dan ukuran sistem) maka pada persamaan termokimia juga tercantum jumlah mol zat yang dinyatakan dengan koefisien reaksi, dan keadaan fasa zat yang terlibat.
Contoh:
a. Pada pembentukan 1 mol air dari gas hidrogen dengan gas oksigen pada 250C (298K), 1 atm, dilepaskan kalor sebesar 286 kJ.
Persamaan termokimia dari pernyataan di atas adalah
Kata “dilepaskan” menyatakan bahwa reaksi tergolong eksoterm. Oleh karena itu,
H = –286 kJ untuk setiap mol air yang terbentuk.
H2(g) + O2(g) → H2O(l) ∆H = –286 kJ
atau,
2H2(g) + O2(g) → 2H2O(l) ∆H = –572 kJ
b. Reaksi karbon dan gas hidrogen membentuk 1 mol C2H2 pada temperatur 250C dan tekanan 1 atm memerlukan kalor 226,7 kJ.
Persamaan termokimianya :
Kata “memerlukan” menyatakan bahwa reaksi tergolong endoterm.
2C(s) + H2(g) → C2H2(g) ∆H = + 226,7 kJ
d. Perubahan Entalpi Standar (∆H0)
Pengukuran pada temperatur 250C, 1 atm disebut sebagai keadaan standar untuk entalpi sebagai perubahan entalpi standar
1. Penentuan Perubahan Entalpi
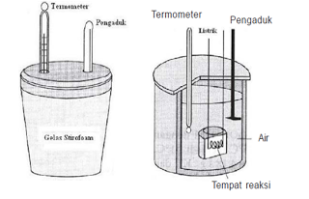
a. Kalorimetri
Kalorimeter Sederhana (kiri) dan kalorimeter Bom (kanan)
Kalorimeter adalah suatu alat untuk mengukur jumlah kalor yang diserap atau dibebaskan sistem. Data H reaksi yang terdapat pada tabel-tabel pada umumnya ditentukan secara kalorimetri.
Kalorimeter sederhana dapat dibuat dari wadah yang bersifat isolator (tidak menyerap kalor). Sehingga wadah dianggap tidak menyerap kalor pada saat reaksi berlangsung.
Kalorimeter Bom merupakan suatu kalorimeter yang dirancang khusus sehingga benar-benar terisolasi. Pada umumnya sering digunakan untuk menentukan perubahan entalpi dari reaksi-reaksi pembakaran yang melibatkan gas.
Meskipun sistem diusahakan terisolasi, tetapi ada kemungkinan sistem masih dapat menyerap atau melepaskan kalor ke lingkungan, dalam hal ini lingkungan nya adalah kalorimeter sendiri. Jika kalorimeter juga terlibat dalam pertukaran kalor, maka besarnya kalor yang diserap atau dilepas oleh kalorimeter (kapasitas kalorimeter, C) harus diperhitungkan.
Jumlah kalor yang dilepas atau diserap sebanding dengan massa, kalor jenis zat, dan perubahan suhu. Hubungannya adalah sebagai berikut:
q = m × c × ∆T
dengan,
q = perubahan kalor (J)
m = massa zat (g)
c = kalor jenis zat (J/g.K)
∆T = perubahan suhu (K)
Contoh Soal:
Pada suatu percobaan direaksikan 50 cm3 larutan HCl 1 M dengan 50 cm3 larutan NaOH 1 M dalam gelas plastik yang kedap panas, ternyata suhunya naik dari 29oC menjadi 35,5oC. Kalor jenis larutan dianggap sama dengan kalor jenis air yaitu 4,18 Jg–1K–1 dan massa jenis larutan dianggap 1 g/cm3. Tentukan perubahan entalpi dari reaksi:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Jawab :
qsistem = qlarutan + qkalorimeter
karena qkal diabaikan, maka
qsistem = qlarutan
massa larutan = volume larutan × massa jenis air
= 100 cm3 × 1 g/cm3
= 100 g
T = (35,5 – 29)oC
= 6,5oC
atau
T = (35,5 + 273)K – (29 + 273)K
= 6,5 K
qlarutan = mlarutan × clarutan × T
= 100 g × 4,18 J g–1K–1 × 6,5 K
= 2717 Joule
= 2,72 kJ
mol NaOH = mol HCl
= 0,05 L × 1 mol L–1
= 0,05 mol
Jadi, pada reaksi antara 0,05 mol NaOH dan 0,05 mol HCl terjadi perubahan kalor sebesar 2,72 kJ. Maka untuk setiap 1 mol NaOH bereaksi dengan 1 mol HCl akan terjadi perubahan kalor :
= 2, 72 kJ : 0,05 mol
= 54,4 kJ/mol
Oleh karena pada saat reaksi suhu sistem naik berarti reaksi berlangsung eksoterm, perubahan entalpinya berharga negatif.
Persamaan termokimianya:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆H = –54,4 kJ
a. Hukum Hess
Perubahan entalpi kadang sukar diukur atau ditentukan langsung dengan percobaan. Pada tahun 1840 Henry Hess dari Jerman menyatakan, perubahan entalpi reaksi hanya tergantung pada keadaan awal dan akhir sistem, tidak bergantung pada jalannya reaksi.
Banyak reaksi dapat berlangsung menurut dua atau lebih tahapan.
Contoh:
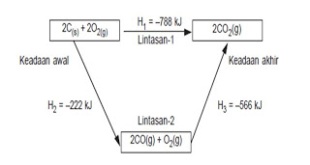
Reaksi karbon dan oksigen untuk membentuk CO2 dapat berlangsung dalam satu tahap (cara langsung) dan dapat juga dua tahap(cara tidak langsung).
1) Satu tahap: C(s) + O2(g) → CO2(g) ∆H = –394 kJ
2) Dua tahap: C(s) + O2(g) → CO(g) ∆H = –110 kJ
CO(g) + O2(g) → CO2(g) ∆H = –284 kJ
C(s) + O2(g) → CO2(g) ∆H = –394 kJ
H dari beberapa reaksi dapat dijumlahkan sesuai dengan penjumlahan reaksi-reaksinya.
Jadi, jika suatu reaksi berlangsung menurut dua tahap atau lebih, maka kalor reaksi totalnya sama dengan jumlah kalor tahap reaksinya. Hukum Hess kita gunakan untuk menghitung H suatu reaksi, berdasarkan beberapa harga H dari reaksi lain yang sudah diketahui.
Hukum Hess dapat dinyatakan dalam bentuk diagram siklus atau diagram tingkat energi. Diagram siklus untuk reaksi pembakaran karbon pada contoh di atas adalah sebagai berikut:
Diagram siklus reaksi pembakaran karbon.
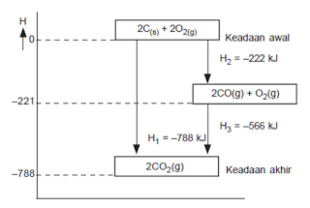
Dari siklus reaksi di atas, pembakaran karbon dapat melalui dua lintasan, yaitu lintasan-1 yang langsung membentuk CO2, sedangkan lintasan-2, mula-mula membentuk CO, kemudian CO2. Jadi H1 = H2 + H3
Diagram tingkat energi:
Diagram tingkat energi reaski karbon dengan oksigen
membentuk CO2 menurut dua lintasan.
a. Menggunakan Entalpi Pembentukan
Kalor suatu reaksi dapat juga ditentukan dari data pembentukan zat pereaksi dan produknya.
Secara umum untuk reaksi:
a PQ + b RS → c PS + d QR
reaktan produk
maka,
H reaksi = [ c. ∆Hf0 PS + d. ∆Hf0 QR] – [ a. ∆Hf0 PQ + b. ∆Hf0 RS]
∆H reaksi = ∆Hf0 (produk) – ∆Hf0 (reaktan)
Contoh soal:
Tentukan entalpi reaksi pembakaran etanol, jika diketahui :
∆Hf0 C2H5OH = –266 kJ
∆Hf0 CO2 = –394 kJ
∆Hf0 H2O = –286 kJ
Jawab:
Reaksi pembakaran etanol :
C2H5OH + O2(g) → 2CO2 + 3H2O
∆H reaksi = [2 ∆Hf0 CO2 + 3 ∆Hf0 H2O] – [1 ∆Hf0 C2H5OH + 1 ∆Hf0 O2]
= [2 (–394) + 3 (–286)] kJ – [1 (–266) + 1 (0)] kJ
= [–1646 + 266] kJ
= –1380 kJ
1. Energi Ikatan
Pada dasarnya reaksi kimia terdiri dari dua proses, yaitu pemutusan ikatan antar atom-atom dari senyawa yang bereaksi (proses yang memerlukan energi) dan penggabungan ikatan kembali dari atom-atom yang terlibat reaksi sehingga membentuk susunan baru (proses yang membebaskan energi).
Perubahan entalpi reaksi dapat dihitung dengan menggunakan data energi ikatan. Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan oleh satu molekul gas menjadi atom-atom dalam keadaan gas. Harga energi ikatan selalu positif, dengan satuan kJ atau kkal, serta diukur pada kondisi zat-zat berwujud gas.
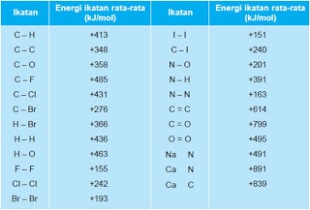
Energi Ikatan Rata-rata dari beberapa ikatan
Menghitung ∆H reaksi berdasarkan energi ikatan:
∆H = ∑ Energi ikatan yang diputuskan – ∑ Energi ikatan yang terbentuk
Contoh Soal:
Dengan menggunakan tabel energi ikatan, tentukan (ramalkan) energi yang dibebaskan pada pembakaran gas metana.
Jawab:
Reaksi pembakaran gas metana :
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Pemutusan Ikatan: Pembentukan ikatan:
4 mol C – H = 1652 kJ 2 mol C = O = 1598 kJ
2 mol O = O = 990 kJ + 4 mol O – H = 1852 kJ +
= 2642 kJ = 3450 kJ
∆H = ∑ Energi ikatan yang diputuskan – ∑ Energi ikatan yang terbentuk
= (2642 – 3450) kJ = –808 kJ
∆H reaksi bertanda negatif, artinya ikatan dalam produk lebih kuat daripada ikatan dalam pereaksi.
Entalpi reaksi yang dihitung berdasarkan harga energi ikatan rata-rata sering berbeda dari entalpi reaksi yang dihitung berdasarkan harga entalpi pembentukan standar. Perbedaan ini terjadi karena energi ikatan yang terdapat dalam suatu tabel adalah energi ikatan rata-rata. Energi ikatan C – H dalam contoh di atas bukan ikatan C – H dalam CH4, melainkan energi ikatan rata-rata C – H.
CH4(g) → CH3(g) + H(g) ∆H = +424 kJ/mol
CH3(g) → CH2(g) + H(g) ∆H = +480 kJ/mol
CH2(g) → CH(g) + H(g) ∆H = +425 kJ/mol
CH(g) → C(g) + H(g) ∆H = +335 kJ/mol
Jadi, energi ikatan rata-rata dari ikatan C – H adalah 416 kJ/mol. Sedangkan energi ikatan C – H yang dipakai di atas adalah +413 kJ/mol.
1. Bahan Bakar dan Perubahan Entalpi
Reaksi pembakaran adalah reaksi suatu zat dengan oksigen. Biasanya reaksi semacam ini digunakan untuk menghasilkan energi. Bahan bakar adalah merupakan suatu senyawa yang bila dilakukan pembakaran terhadapnya dihasilkan kalor yang dapat dimanfaatkan untuk berbagai keperluan.
Jenis bahan bakar yang banyak kita kenal adalah bahan bakar fosil. Bahan bakar fosil berasal dari pelapukan sisa organisme, baik tumbuhan maupun hewan yang memerlukan waktu ribuan sampai jutaan tahun, contohnya minyak bumi dan batu bara. Namun selain bahan bakar fosil dewasa ini telah dikembangkan pula bahan bakar jenis lain, misalnya alkohol dan hidrogen. Hidrogen cair dengan oksigen cair bersama-sama telah digunakan pada pesawat ulang-alik sebagai bahan bakar roket pendorongnya. Pembakaran hidrogen tidak memberi dampak negatif pada lingkungan karena hasil pembakarannya adalah air.
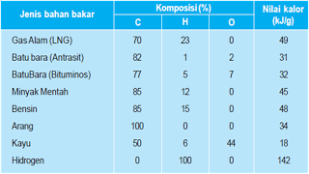
Matahari adalah sumber energi terbesar di bumi, tetapi penggunaan energi surya belum komersial. Dewasa ini penggunaan energi surya yang komersial adalah untuk pemanas air rumah tangga (solar water heater). Di bawah ini adalah nilai kalor dari berbagai jenis bahan bakar yang umum dikenal:
Nilai kalor bakar beberapa bahan bakar
Nilai kalor dari bahan bakar umumnya dinyatakan dalam satuan kJ/gram, yang menyatakan berapa kJ kalor yang dapat dihasilkan dari pembakaran 1 gram bahan bakar tersebut. Contoh : nilai kalor bahan bakar bensin adalah 48 kJ/g, artinya setiap pembakaran sempurna 1 gram bensin akan dihasilkan kalor sebesar 48 kJ.
Pembakaran bahan bakar dalam mesin kendaraan atau dalam industri umumnya tidak terbakar sempurna. Pembakaran sempurna senyawa hidrokarbon (bahan bakar fosil) membentuk karbon dioksida dan uap air. Sedangkan pembakaran tidak sempurnanya menghasilkan karbon monoksida dan uap air.
Pembakaran tak sempurna mengurangi efisiensi bahan bakar, kalor yang dihasilkan akan lebih sedikit dibandingkan apabila zat itu terbakar sempurna. Kerugian lainnya adalah dihasilkannya gas karbon monoksida (CO) yang bersifat racun. Nilai kalor bakar dapat digunakan untuk memperkirakan harga energi suatu bahan bakar.
Diambil dari tulisan Hairina



Assalammu’alaykum…..dibaca, dipahami tulisannya, sebagai tanda kehadiran anda, anda harus memberikan komentar pada tulisan ini. Terakhir! tugasnya dikerjakan latihan dari diktat kimia fisika 1 bab Termokimia
By: risars on 5 November 2013
at 10:55 pm
Bahan bakar CO sangat beracun seharusnya tidak boleh di pakai lagi tapi di indonesia kesulitan dana untuk mengantikan bahan bakar yang lebih aman dan tidak beracun. Berbeda dengan di luarnegeri sudah tidak lagi mengginakan bahan bakar CO.
By: chindy conchita c.s 1211208013 on 6 November 2013
at 1:02 am
asslmualaikum.. wr.wb…
sebelumnya terimakasih atas materinya.! dan mohon ijin untuk mendownloadnya. dari materi yang saya baca, tidak semuanya dapat saya pahami, mungkin harus beberapa kali untuk memahaminya dan perlu di bahas bersama sama. komentar saya untuk tulisan ini, baik, sistematis, dan contoh contohnya mudah di pahami. mungkin itu saja… terimakasi, wasalm..
By: galih.purnama on 6 November 2013
at 1:49 am
pembakaran sempurna 1 gram bensin akan dihasilkan kalor sebesar 48 kJ.di dalamnya terdapat hukum Hess yang menyatakan perubahan entalpi reaksi hanya tergantung pada keadaan awal dan akhir sistem, tidak bergantung pada jalannya reaksi.
By: ramdhan Firmansyah on 6 November 2013
at 2:40 am
Alam semesta ciptaan Tuhan memiliki energi yang konstan. Berdasarkan asas kekekalan energi yang tidak dapat diciptakan atau memusnahkan energi. Yang dapat kita lakukan hanyalah mengubah suatu bentuk energi menjdi bentuk energi yang lain. seperti halnya dalam alquran alloh tidak akan merubah suatu kaum kecuali kaum itu sendiri yang merubahnya. Di alam ini banyak sekali terjadi berbagai energi, contohnya energi kinetik, potensial, mekanik dan lain sebagainnya. dan contohnya pun seperti kita harus bekerja keras dengan energi yang kita punya untuk merubah kehidupan kita
terimakasih bu atas materinya, bermanfaat sekali..
By: siti sarah patmawati on 6 November 2013
at 2:46 am
subhanallah bunyi hukum termodinamika I, mengandung hikmah yang bermanfaat bagi kehidupan.
terimaksih bu ats materinya.
By: siti maya zainabul afiah on 6 November 2013
at 2:58 am
subhanalloh hukum termodinamika pertama ” eneegi tidak dapat diciptakan dan tidak dapat dimusnahkan” mengandung hikmah yang bermanfaat bagi kehidupan.
By: siti maya zainabul afiah on 6 November 2013
at 3:06 am
materi termokimia ini sangat menarik sekali untuk di kaji. sangat bermanfaat sekali bagi saya. terimakasih bu. 😉
By: Lina Khoerunisa on 6 November 2013
at 3:08 am
assalamualaikum wr.wb.
materi termokimia ini sangat bermanfaat sekali untuk saya dan tentu sangat membantu dalam proses belajar, namun ada beberapa hal yang belum saya mengerti. dan saya mohon izin untuk mendownload materi ini.
terimakasih.
By: Mia Hentiana (1211208051) on 6 November 2013
at 3:14 am
Assalamualaikum.. Wr.Wb
ibu saya ingin bertanya ,kan setiap gerakan, dipengaruhi oleh banyak faktor dan dapat berubah bentuk saling bertumbukan. yang menyebabkan energi gerakan satu partikel akan berbeda dengan yang lain. apa saja faktor-faktornya ?
By: nisa nursyarifah on 6 November 2013
at 4:09 am
Assalamualaikum .. Wr.Wb
dewasa ini telah dikembangkan pula bahan bakar jenis lain, misalnya alkohol dan hidrogen. Hidrogen cair dengan oksigen cair bersama-sama telah digunakan pada pesawat ulang-alik sebagai bahan bakar roket pendorongnya. Pembakaran hidrogen tidak memberi dampak negatif pada lingkungan karena hasil pembakarannya adalah air. pertanyaannya dapatkan bahan bakar alternatif itu digunakan pada kendaraan roda empat biasa (mobil) ?
By: nina maidah on 6 November 2013
at 4:23 am
Oh ya bu sekalian mau tnya, td kalo ga salah baca disebutkan bhwa pd suhu 0*K bnyak materi kecil berbentuk molekul yg bergerak acak, saling bertumbukan dan berpantulan. Kenapa itu bisa terjadi dan bagaimana pd suhu lebih tinggi dan kecil..?
By: Akhmad hanafi on 6 November 2013
at 12:52 am
coba dibaca lagi, apa pernyataannya tepat atau kebalikannya…?
By: risars on 6 November 2013
at 1:10 am
Pd mteri diatas pas sub bab energi yg pernyataan teori energi kinetik disebutkan gitu bu.., pernah dengar juga kalo pas 0*K tidak ada kehidupan.., mkasih bu..
By: Akhmad hanafi on 6 November 2013
at 1:23 am
assalamualikum ibu saya luthfia materinya sangat bermanfaat bagi kami dan terimakasih ibu. dan saya ingin menanyakan , bagaimana kalau kita membuat alat kalorimetri sederhana yang dibuat oleh kita sendiri apakah kalorimetri itu dapat efisien dalam segi pengukuran dan hasilnya ? dan biaya yang dikelurakan itu mahal atau tidak bu?
terimakasih sebelumnya bu
By: luthfia fauzia on 6 November 2013
at 3:19 am
Assalamualaikum
Nama: Aris Wahyudin (1211208010)
Perubahan Entalpi dapat di tentukan dengan menggunakan alat yang dinamakan kalorimeter. kalorimeter ada 2 yaitu kalorimeter sederhana, dan kalorimeter bom. Kalorimeter sederhana dapat dibuat dari wadah yang bersifat isolator (tidak menyerap kalor). Sehingga wadah dianggap tidak menyerap kalor pada saat reaksi berlangsung, pertanyaannya bu, apakah kalorimeter sederhana masih akurat untuk menghitung perubahan entalpi??
By: Aris Wahyudin on 6 November 2013
at 12:57 am
🙂 hanya sebagai pendekatan saja, kalau akurasi sy pikir tidak bisa menggunakan kalorimeter sederhana
By: risars on 6 November 2013
at 1:14 am
Oh iya terimakasih bu.. 🙂
sukses Bu buat pelatihannya..
By: Aris Wahyudin on 6 November 2013
at 1:31 am
Wasslam.alhamdulillah materinya i. alloh mudah dipahami. karena mengulang materi pelaaran SMA.mudah2an masih tetap mudah materinya sampai dengan menjelang UAS.Aamiin.Cep Budi KImia VII A
By: Cep Budi Zulkarnaen on 6 November 2013
at 1:04 am
aamiin
By: risars on 6 November 2013
at 1:15 am
ohh….ternyata termodinamika kimia itu digunakan untuk memperkirakan perubahan energi yang terjadi dalam proses-proses reaksi kimia, perubahan fase, dan pembentukan larutan.
tugas latihannya segera dikerjakan… 🙂
By: Agung Nugraha on 6 November 2013
at 1:06 am
berdasarkan perubhan entalpi berikut :
1) perbhn entlpi pembntkn
2) perbhn entlpi penguraian
3) perbhn entlpi pembkran
dari ketiga perbhan entalpi tsb mana yg membthkan energi plg besar ?
By: euis hapidoh dohiroh on 6 November 2013
at 1:07 am
Pada sub bab hukum hess itu bermanfaat untuk menentukan entalpi reaksi yang sulit di tentukan secara eksperimen. Mengapa hal itu bisa terjadi?
By: Hani haviyani (1211208034) on 6 November 2013
at 1:11 am
assalamualaikum.
nama : Desi Maryani (1211208016)
Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia.di dalamnya terdapat hukum Hess yang menyatakan perubahan entalpi reaksi hanya tergantung pada keadaan awal dan akhir sistem, tidak bergantung pada jalannya reaksi.pertanyaannya bagaimana proses perubahan entalpi reaksi dalam proses percobaan?apakah dalam perubahan entalpi hanya tergantung dalam keadaan awal atau akhir saja?
terima kasih ibu.
By: desi maryani on 6 November 2013
at 1:13 am
makasih bu, materi termokimianya sangat membantu saya untuk menambah referensi..
untuk tugasnya segera dikerjakan
sukses buat acaranya bu 🙂
By: Devi Kurniawati on 6 November 2013
at 1:13 am
Hubungan energi dalam dan entalpi.
Tekanan sebelum & sesudah reaksi pd zat padat dan cair dapat mempengaruhi harga entalpi tetapi dlm keadaan gas dapat d abaikn..
Mengapa demikian, bu?
By: Abdul Azis on 6 November 2013
at 1:14 am
Setiap gerakan dipengaaruhi banyak faktor dan dapat berubah bentuk saling bertumbukan. Faktor apa saja yang dapat mempengaruhi gerakan ?
By: intan Elmash MP on 6 November 2013
at 1:19 am
assalamualaikum. .
Afiah (1211208002).
Ibu. .kalau secara literatur menyatakan reaksi NaOH dan HCl kan melepaskan kalor. Jika melepaskan kalor suhunya harus turun, tetapi faktanya naik. Bagaimana menjelaskan fakta tersebut di hubungkan dengan studi literatur ?
By: afiah on 6 November 2013
at 1:22 am
Perubahan entalpi semua zat disepakati pada suhu 298 K dan 1atm, apakah perubahan entalpi semua zat tidak bisa di ukur pada suhu yang lebih besar atau yang lebih kecil misal pada suhu 300K?
By: Indri Ramadayanti RN on 6 November 2013
at 1:24 am
waalaikumslaam
Ibu selain hkum Hess adakah hukum lain yang bisa digunakan dalam termokimia ?
Farisa Nur Azizah (1211208030)
By: farissafaddong on 6 November 2013
at 1:28 am
Saya hadir bu… Hehe
Komentar saya dan yang dapat saya pahami dari tulisan ini bahwa : hukum termodinamika 1 berhubungan dengan sistem dan lingkungan, keadaan sistem dan persamaan keadaan, fungsi keadaan, perubahan keadaan, kalor dan kerja. Adaa kerja yang dihasilkan pada ekspansi reversibel dan pada irreversibel. Disamping itu adaa energi dalam, dan entalpi, entalpi banyak macam nya: entalpi pelarutan, entalpi pembentukan, entalpi pembakaran dan adaa hukum hess. Serta entalpi ikatan dan energi ikatan, disamping itu adaa bahan bakar dari fosil, alkohol dan alternatif lain, matahari adalah bahan bakar surya terbesar..
Bu mau tanya, kan bahan bakar terbesar itu matahari, dan sekarang baru digunakan untuk pemanas air rumah tangga, bagaimana itu cara kerjanya dari matahari sebagai sel surya terbesar bisa diaplikasikan untuk hal itu,
Terima kasih bu..
By: Elis Liskania Arfiani 1211208024 on 6 November 2013
at 1:28 am
Assalamualaikum
Nama : Deriz Rizki M (1211208015)
Kalorimeter adalah suatu alat untuk mengukur jumlah kalor yang diserap atau dibebaskan sistem. Data H reaksi yang terdapat pada tabel-tabel pada umumnya ditentukan secara kalorimetri. Kalorimeter terdiri dari dua jenis, yaitu kalorimeter sederhana dan kalorimeter bom. Tetapi tidak dijelaskan kelebihan dari masing-masing kalorimeter tersebut. Pertayaannya, apa kelebihan dari kalorimeter bom dibandingkan kalorimeter sederhana?
By: Deriz Rizki Maulani on 6 November 2013
at 1:28 am
Materi termokimia d blog ibu sangat membantu kita dlam tambahan materi termokimia yg ada di buku.
Namun ada yg ingin d tanyakan,pada suatu proses termokimia kan berlangsung pda volume dan tkanan tetap,tapi knpa pada eksperimen d laboratorium lbih bnyak dilakukan pda tekanan tetap,apakah mgkin pda eksperimen d lab d lakukan jga pda volume tetap..?
By: denia novianti on 6 November 2013
at 1:28 am
Termokimia berkaitan dengan reaksi reaksi kimia yg didalamnya dijelaskan tentang kalor dari reaksi
By: Euis Hasanah on 6 November 2013
at 1:29 am
Ternyata hukum Hess ditemukan oleh orang jerman..teopebegete lah buat jerman..smoga orang indonesia segera menyusul… 🙂
makasih buat materinya..semoga bermaanfaat.
tugasnya menyusul… 🙂
By: Eri syaripah s on 6 November 2013
at 1:31 am
Kalor reaksi merupakan entalpi sistem yang dihasilkan dari reaksi kimia
By: Imam Agus Faisal Hudawi on 6 November 2013
at 1:32 am
Assalamualaykum
Bu maaf mau tanya, untuk entalpi penguraian apakah sama perhitungannya seperti entalpi pembntukan?
Produk dikurang pereaksi.
Terima kasih
By: apep nurdiyanto on 6 November 2013
at 1:36 am
Jadi, dapat diaimpulkan pada persamaan termokimia keadaan awal dan keadaan akhir reaksi harus memiliki suhu dan tekanam yang sama 😀
By: Ela Barokah on 6 November 2013
at 1:37 am
Assalamualaikum Wr. Wb
Dio Guntara (1211208021)
Pendidikan Kimia VA
Dikarenakan harus mengisi komentar dan menurut Dio komentar harus didasari dengan suatu masalah. Jd Dio akan isi komentar ini dengan suatu pernyataan:
“Termokimia ini difokuskan pada bahasan tentang perubahan kalor. Dan aplikasinya pada kehidupan sehari-hari mungkin buli-buli masuk bu. Buli-buli adalah suatu alat berbentuk kantung yg bisa diisi dengan suatu cairan yang dapat digunakan untuk mengompres org yg sakit. Cairan bisa bersuhu tinggi atau pun rendah.”
Risa RS
apa itu buli-buli Dio?
By: Dio Guntara on 6 November 2013
at 1:37 am
Buli2 itu buat ngompres orang sakit..
D isinya bsa air panas sm air dingin..
By: Dio Guntara on 6 November 2013
at 1:55 am
berdasarkn bnyi hk. termdnmka 1 bhw energ tdk dpt dmusnhkan dan dcptkan ttp hny dpt drubh ke bntk yg lain. .
krn energ tdk dcptakan mk stiap energ yg kita miliki kita pergunakn sebaik-baiknya sesuai yg kita butuhkn..sehingga menghasilkan energi yg positip.
By: euis marliani on 6 November 2013
at 1:39 am
makasih ibu buat materinya, sangat terperinci dan butuh pemahaman lebih. tinggal diaplikasikan kedalam soal-soal tentang termokimia termasuk tugas yang ibu kasih.
sangat bermanfaat untuk bahan referensi buat saya 🙂
By: Dewi ulfah Nurazizah on 6 November 2013
at 1:39 am
Saya sudah baca materinya…makasih mudah-mudahan bermanfaat.
tugasnya akan dikerjakan..
By: Hardi Saepul Huda on 6 November 2013
at 1:43 am
materinya mudah d pahami insya allah..
.bahwa termokimia itu dapat berlangsung pada volum tetap atau tekanan tetap,.
By: imronah nurlailiyah(1211208038) on 6 November 2013
at 1:44 am
Mengapa d laboratorium, entalpi reaksi biasanya diperoleh dari hasil pengukuran suhu ?
By: erisa gina rinjani on 6 November 2013
at 1:45 am
Materi termokimia dibahas di SMA juga, disini pada materi termokimia apakah setiap reaksi kimia selalu disertai dengan perubahan energi ??
By: ano on 6 November 2013
at 1:46 am
Materi termokimia dibahas di SMA juga, disini pada materi termokimia apakah setiap reaksi kimia selalu disertai dengan perubahan energi ??
By: Ani Dewiratnasari on 6 November 2013
at 1:49 am
Berhubung bahwa termokimia adalah salah satu aplikasi dari hukum pertama termodinamika maka dpt dikatakan bahwa termokimia ini berkaitan dgn hukum kekekalan energi untuk sebuah sistem yang sedang melakukan pertukaran energi dgn lingkungan dan memberikan hubungan antara kalor, energi dan kerja (usaha) .
By: Fithriyah on 6 November 2013
at 1:49 am
Kesimpulannya: untuk menjelaskan bahwa perubahan entalpi reaksi tidak dipengaruhi oleh perubahan entalpi karena perbedaan variabel keadaan sistem,dapat dijelaskan dengan asumsi sistem mengalami dua tahap perubahan: tahap pertama adalah perubahan reaktan (pada
T dan P) menjadi produk (pada T dan P ) yang berlangsung secara adiabat.tahap kedua adalah perubahan variabel keadaan produk dari T dan P kembali menjadi keadaan awal (T dan P).
By: Dewi Suci Novitasari 1211208013 on 6 November 2013
at 1:52 am
Ibu materi mengenai termokimia ini sangat bermanfaat bagi saya dan umumnya bagi teman”.. semoga pas uas nanti kita semua dimudahkan dari soal” ibu.. hehe .. dan semoga ibu sukses dengan pelatihannya.. amiin
By: isni novitasari on 6 November 2013
at 1:53 am
Walaikumsalam wr wb
Perubahan reaktan dan perubahan variabel dapat menjelaskan bahwa perubahan entalpi reaksi tidak dipengaruhi oleh perubahan entalpi karena perbedaan variabel keadaan sistem.
Terimakasih bu atas materinya.
By: Asri Fadiylah on 6 November 2013
at 1:53 am
Yang sedikit saya tangkap dari materi termodinamika adalah kalor yang menyertai suatu proses pada volume tetap merupakan perubahan energi dalam, sedangkan pada tekanan tetap merupakan perubahan entalpi.
Terima kasih ibu 😀
By: Ani Yunaningsih on 6 November 2013
at 1:55 am
Assalamualaikum.
Ibu, kan di atas di sebutkan bahwa pembakaran sempurna 1 gram bensin akan dihasilkan kalor sebesar 48 kJ, sedangkan mesin itu tidak ada yang mempunyai efisiensi 100 %. Nah, apakah kalor hasil pembakaran itu tetap akan menghasilkan kalor sebesar 48 kJ atau tidak?
Terima kasih
By: Ilham 1211208036 on 6 November 2013
at 2:15 am
materinya mudah untuk saya pahami, makasih Bu, semoga bermanfaat 🙂
By: Ajeng Dalli on 6 November 2013
at 2:17 am
materinya sangat rinci dan mudah dimengerti. 🙂
tugasnya menyusul Bu.. 🙂
By: Handini Nurpratami on 6 November 2013
at 2:19 am
terima kasih kepada ibu dengan materi termokimia yang telah diberikan
sangat bermanfaat sekali bagi saya 🙂
tugasnya akan segera dikerjakan
By: diny merida aryana on 6 November 2013
at 2:25 am
Terimakasih atas informasinya bu, mmpermudah pencarian dan pemahaman ttg ini, saya pelajari lebih lanjut
By: Nisa Kusumah Bangsa on 6 November 2013
at 2:37 am
Terimakasih bu materinya menambah referensi ,mempermudah pencarian informasi , sy pelajri lebih lanjut bu
By: Nisa Kusumah Bangsa on 6 November 2013
at 2:41 am
Assalamualaikum , Materinya sudah dibuka bu selebihnya akan saya baca dan pahami dirumah sbelumnya terimakasih atas informasi mengenai materi ini . . .
By: Neng Erni Handayani on 6 November 2013
at 2:44 am
Ratnasari 1211208068
bu kalorimeter itukan bisa dibuat dari wadah yg bersifat isolator.nah kalau di SMA terus mereka tidak mempunyai fasilitas sama sekali bahkan dikampung, bisa dibikin dari apa kalorimeternya? contoh bahannya apa?
makasih bu
By: Ratnasari on 6 November 2013
at 2:45 am
Assalamualaikum ibu
Sebelumnya saya sudah pernah bertemu dengan materi termokimia di sma kelas XI, jadi sudah lumayan dikenal ga terlalu blank bu, tp ada beberapa materi yang baru dikenal
Alhamdulillah bisa diingatkan kembali oleh materi diatas, tinggal diperdalam kembali biar ga lupa” lagi.
Makasih ibu 🙂
By: Lina Lailasari on 6 November 2013
at 2:48 am
Assalamu’alaikum ibu..
Ibu saya mau bertanya Faktor apa saja yang menyebabkan suatu pembakaran menjadi tidak sempurna, dan bagaimana mekanisme bahan bakar roket sehingga bisa mendorong roket untuk meluncur ke udara?? apa hal itu juga ada kaitannya dengan termokimia? terimakasih bu wassalamu’alaikum
By: Tia Sintiyawati on 6 November 2013
at 2:52 am
Hukum Hess dapat dinyatakan dalam bentuk diagram siklus atau diagram tingkat energi. adakah bisa dalam bentuk selain diagram siklus bu ? 🙂
By: Nadya Rahmania on 6 November 2013
at 2:57 am
Subhanallooh, maha kuasa Alloh yang telah menciptakan energi untuk keberlangsungan makhluknya.
Alam semesta ciptaan Tuhan memiliki energi yang konstan.yang dapat kita lakukan hanyalah mengubah suatu bentuk energi menjadi bentuk energi yang lain.
syukron bu, dengan mempelajari termokimia tidak hanya mendapatkan ilmu umum melainkan menjadikan kita lebih dekat dengan Alloh…
By: Reni Fathiyah Azkiani on 6 November 2013
at 2:58 am
terimakasih ibu materinya.. ibu kan entalpi pembentukan untuk unsur seperti O2 itu nilainya 0. Yang sy ingin tanyakan bagaimana menjelaskan kepada siswa hal tersebut bisa terjadi?
tugasnya insyaalloh dikerjakan…
By: Lilis Rusmiati on 6 November 2013
at 2:58 am
ibu bagaimana perbedaan cara kerja kalorimeter sederhana dengan kalorimeter bom?
By: RESTI YULIANTI H (kimia VB) on 6 November 2013
at 3:03 am
Assalamualaikum….
Ibu terimakasih materinya…
tapi saya masih belum faham kalau sekedar d baca dan d fahami…
pengennnnnnnnnnnnnnnn d jelaskan d depan kelas ibuuuuuuuuu……..
izin download materinyaaaaaa……
By: Purwanti Laelasari on 6 November 2013
at 3:04 am
Assalamualaikum ibu
Sebelumnya saya sudah pernah bertemu dengan materi termokimia di sma kelas XI, jadi sudah lumayan dikenal ga terlalu blank bu, tp ada beberapa materi yang baru dikenal
Alhamdulillah bisa diingatkan kembali oleh materi diatas, tinggal diperdalam kembali biar ga lupa” lagi.
Makasih ibu 😀
By: Lina Lailasari on 6 November 2013
at 3:06 am
Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan oleh satu molekul gas menjadi atom-atom dalam keadaan gas.
ibu berarti kalau di suatu reaksi terdapat aquos dan liquid energi ikatannya samadengan 0 ???
terimakasih ibu….. 🙂
By: pebry nopimasari VB on 6 November 2013
at 3:09 am
aplikasi dalam kehidupan sehari-hari pada perubahan entalpi yaitu perubahan energi mobil yang berpindah tempat dari satu titik ke titik lain mengenai termokimia..
terima kasih bu ..
By: Utari Rizki Amalia on 6 November 2013
at 3:09 am
penjelasan materi yang ibu paparkan enak untuk di baca di hayati dan di pahami…
terima kasih ibu…semoga bermanfaat dan berkah…
By: ramlan burhanudin on 6 November 2013
at 3:11 am
Terimakasih bu, Materinya sudah sy baca , nanti sy pelajari lebih lanjut, , tugasnya dilanjutkan dikerjakan bu
By: nisa kusumah bangsa on 6 November 2013
at 3:12 am
intinya termodinamika merupakan ilmu yang mempelajari tentang perubahan energi yang berkaitan dengan kalor/panas. karna sesuai dengan hukum kekekalan energi bahwa energi itu tidak bisa diciptakan dan tidak bisa dimusnahkan hanya saja bisa dirubah dari satu energi ke energi yang lain..
By: Yuliyanti on 6 November 2013
at 3:15 am
yuliyanti (1211208083) : intinya termokimia adalah ilmu yang mempelajari mengenai perubahan energi yang berhubungan dengan kalor/panas. karna sesuai dengan hukum keekalan energi bahwa energi itu tidak dapat diciptakan dan tidak dapat dimusnahkan. jadi hanya bisa dirubah dari energi yang satu ke energi yang lain…
By: Yuliyanti 1211208083 on 6 November 2013
at 3:20 am
Assalamualaikum,,,
bu mau tanya, apa yang menyebabkan pembakaran tak sempurna? dan bagaimana cara untuk mencegah pembakaran tak sempurna?
terima kasih atas materinya, dan izin download.
Kartika Noermalasari, VB
By: Kartika Noermalasari on 6 November 2013
at 3:20 am
Assalamualaikum ibu , materinya sangat menarik dan menambah pengetahuan baru , pelajaran termokimia ini sangat erat hubungannya dgn kehidupan sehari2 misalkan hkm termodinamika 1 , oh iya bu mia ingin bertanya td disebutkan bahwa kalorimeter merupakan sistem terisolasi tp mengapa masih dapat menyerap atau melepaskan kalor ? Apakah sesuai dgn hkm termodinamka 1? Terimakasih ibu , wassalamualaikum
By: Mia Lisnawati on 6 November 2013
at 3:22 am
Assalamualaikum
makasih ibu materinya lengkap sekali. memang materi ini pernah d pelajari d sma dulu. tapi sekarang harus lebih mengerti secara terperinci lagi sehingga materi yang ibu berikan sangat bermanfaat sekali. makasih bu 🙂
By: Nuni Handini on 6 November 2013
at 3:23 am
Assalamu alaikum..
alhamdulillah materi nya sudah saya baca dan mudah di pahami, dan sangat bermanfaat untuk kehidupan sehari-hari.
tugas nya menyusul ia bu,
By: Rijal muttaqin on 6 November 2013
at 3:24 am
assalamualaikum
subhanallah materinya cukup sulit untuk difahami,perlu beberapa kali membaca untuk memahami semua materi dan lebih banyak latihan soal untuk memahami ilmu terapannya . .
wassalamualaikum
By: ramdhan Firmansyah on 6 November 2013
at 3:29 am
assalamualaikum wr.wb.
lisna layung sari (1211208049)
*jadi jika suatu reaksi berlangsung menurut dua tahap atau lebih, maka kalor reaksi totalnya sama dengan jumlah kalor tahap reaksinya.
*nilai kalor bakar dapat digunakan untuk memperkirakan harga energi suatu bahan bakar. maksudnya harga bahan bakar itu bisa diketahui dari nilai kalor bakarnya bu?
By: Lisna Layung Sari (1211208049) kimia v.B on 6 November 2013
at 3:30 am
sarah nurul aini
pendidikan kimia 5B
Assalamualaikum ibu, setelah membaca materi di atas, saya mendapatkan beberapa hal, salah satunya adalah bahwa semakin besarnya kalor yang dimiliki suatu senyawa yang dapat di gunakan sebagai bahan bakar, berarti semakin baik hasil pembakarannya untuk kesehatan di bumi. contohnya hidrogen yang memiliki kalor sebesar 142 KJ/gram, akan menghasilkan gas karbondioksida dan air, sedangkan bensin yang memiliki kalor 48 Kj/gram, menghasilkan gas karbonmonoksida dan air yang berbahaya bagi kesehatan di bumi.
tapi ibu, berarti apakah semua senyawa yang memiliki nilai kalor yang tinggi akan menghasilkan gas hasil pembakaran karbondioksida dan air ketika senyawa itu di gunakan sebagai bahan bakar?
By: Hardi Saepul Huda on 6 November 2013
at 3:32 am
Assalamualaikum..
Nama : Rio Frassetia
Terima Kasih bu atas materinya..
materinya mudah di pahami dan sangat bermanfaat,, 🙂
Termokimia memang penting dalam kehidupan sehari-hari.. ^_^
By: Rio Frassetia on 6 November 2013
at 3:33 am
nita supriantini (1211208061)
V B
ibu,di materi disebutkan Penentuan kalor reaksi pada volume tetap ditentukan dengan menggunakan bom kalorimeter,kenapa dengan kalorimeter bom?apakah bisa dengan kalorimeter sederhana?
By: nita supriantini on 6 November 2013
at 3:36 am
sarah nurul aini
pendidikan kimia 5B
Assalamualaikum ibu, setelah membaca materi di atas, saya mendapatkan beberapa hal, salah satunya adalah bahwa semakin besarnya kalor yang dimiliki suatu senyawa yang dapat di gunakan sebagai bahan bakar, berarti semakin baik hasil pembakarannya untuk kesehatan di bumi. contohnya hidrogen yang memiliki kalor sebesar 142 KJ/gram, akan menghasilkan gas karbondioksida dan air, sedangkan bensin yang memiliki kalor 48 Kj/gram, menghasilkan gas karbonmonoksida dan air yang berbahaya bagi kesehatan di bumi.
tapi ibu, berarti apakah semua senyawa yang memiliki nilai kalor yang tinggi akan menghasilkan gas hasil pembakaran karbondioksida dan air ketika senyawa itu di gunakan sebagai bahan bakar?
maaf bu, tadi ada kesalahan. kayaknya ini bekas di pakai hardi komputernya
By: sarah nurul aini on 6 November 2013
at 3:38 am
Assalamualaikum
bu, maaf yang ingin saya tanyakan mengapa dalam reaksi netralisasi , perubahan entalpinya selalu eksoterm?
terima kasih atas materinya dan mudah-mudahan bisa bermanfaat .
Nur Laelasari VB.
By: Kartika Noermalasari on 6 November 2013
at 3:40 am
Resti Yulianti H (kimia VB)
ibu bagaimana perbedaan cara kerja antara kalorimeter sederhana dengan kalorimeter bom
By: restiyulianti42 on 6 November 2013
at 3:41 am
Assalamulaikum ,,
bu, kenapa bahan bakar hidrogen mempunyai nilai kalor yang lebih besar daripada bahan bakar yang lainnya..
terima kasih
By: Usman Firdaus (1211208081) Pendidikan Kimia V/B on 6 November 2013
at 3:42 am
assalamualaikum wr. wb…
nela nuralila (1211208056)
ibu mengapa kalau yg hukum hess sulit ditentukan melalui percobaan?bu mau nanya juga kalau untuk menentukan entalpi pada kalorimeter bom itu bagaimana bu?
terima kasih untuk materinya bu..insyaallah mudah dimengerti…semoga lancar ya bu pelatihannya… 🙂
By: nela nurlaila on 6 November 2013
at 3:42 am
Assalamualaikum
bu, maaf yang ingin saya tanyakan mengapa dalam reaksi netralisasi , perubahan entalpinya selalu eksoterm?
terima kasih atas materinya dan mudah-mudahan bisa bermanfaat .
Nur Laelasari VB.
By: Nur Laelasari on 6 November 2013
at 3:45 am
assalamualaikum wr wb…
terima kasih ibu untuk berbagi ilmunya,,semoga bermanfaat bagi yang membaca dan yg mengaplikasikannya,,aamiin..
By: Siti Patonah 1211208077 on 6 November 2013
at 3:46 am
Mirawati (1211208053) Assalamu’alaikum warohmatullah wabarokatuh… afwan bu mau tanya: apakah ada faktor-faktor yang mempengaruhi perubahan entalpi? yang kedua apakah ada alat yang lebih akurat untuk menentukan jumlah kalor yang diserap selain kalorimeter bom? terima Kasih…
By: Mirawati on 6 November 2013
at 3:46 am
Resti Yulianti H ( kimia VB )
Ibu Bagaimana perbedaan cara kerja kalorimeter sederhana dan kalorimeter bom ?
By: restiyulianti42 on 6 November 2013
at 3:47 am
Assalamualaikum
Syifa Padilah hadiiirrr,,,, 🙂
Manfaat mempelajari materi Termokimia
Manfaat positif dari termokimia, yaitu:
1)Dapat mempelajari suatu bentuk energi yang dibutuhkan oleh manusia untuk bergerak dalam bentuk energi kinetik dan tambahan-tambahan dalam melakukan proses fotosintesis yang membutuhkan eergi dari sinar matahari.
2)Dapat mempelajari suatu sistem atau bagian alam semasta yang menjadi objek penelitian serta lingkungan atau bagian alam semesta yang berinteraksi dengan satu sistem.
By: Syifa Padilah 1211208079 on 6 November 2013
at 3:48 am
Ratnasari 1211208068
bu kalau termokimia sederhana kan dibuat dari wadah terisolasi. nah kalau dibuat untuk anak SMA tapi disekolah fasilitas tidak ada dan SMA nya di pedalaman/terisolasi.jadi dibuatnya dari apa? bahannya dari apa?
makasih bu
By: Ratnasari on 6 November 2013
at 3:48 am
assalamualaikum
Alam semesta ciptaan Tuhan memiliki energi yang konstan. Berdasarkan asas kekekalan energi yang tidak dapat diciptakan atau memusnahkan energi. Yang dapat kita lakukan hanyalah mengubah suatu bentuk energi menjdi bentuk energi yang lain.
setelah saya memahami kalimat diatas, kalau dikaitkan pengertiannya bisa sama dengan takdir/nasib seseorang,bahwa Allah berfirman, sesungguhnya Allah tidak akan merubah nasib seseorang, kecuali dia sendiri yang merubahnya, hal ini menunjukkan betapa adilnya Allah SWT.
materinya sudah rinci bu, mungkin ada sedikit kurang teliti dalam penulisan kata.
terimakasih bu 🙂
wassalam
By: salwa wasilatul karimah on 6 November 2013
at 3:51 am
Nita Supriantini – VB
ibu,dimateri disebutkan Penentuan kalor reaksi pada volume tetap ditentukan dengan menggunakan bom kalorimeter,kenapa dengan kalorimeter bom?apakah bisa dengan kalorimeter sederana?
By: nita supriantini on 6 November 2013
at 3:54 am
materinya baru saya baca sekilas bu 😀
tapi nanti akan saya baca lebih mendalam…
tugas juga akan dikerjakan…
terimakasih 🙂
By: rini nurlani on 6 November 2013
at 3:57 am
subhanallah sekali,,,Allah menciptakan Alam semesta dengan memiliki energi yang konstan. terima kasih ats materinya bu,,moga dapat menambah peengetahuan dan pemahaman saya.^_^
By: Kristin Shinta Dewi on 6 November 2013
at 4:00 am
SALWA WASILATUL KARIMAH VB
assalamualaikum
Alam semesta ciptaan Tuhan memiliki energi yang konstan. Berdasarkan asas kekekalan energi yang tidak dapat diciptakan atau memusnahkan energi. Yang dapat kita lakukan hanyalah mengubah suatu bentuk energi menjdi bentuk energi yang lain.
setelah saya memahami kalimat diatas, kalau dikaitkan pengertiannya bisa sama dengan takdir/nasib seseorang,bahwa Allah berfirman, sesungguhnya Allah tidak akan merubah nasib seseorang, kecuali dia sendiri yang merubahnya, hal ini menunjukkan betapa adilnya Allah SWT.
materinya sudah rinci bu, mungkin ada sedikit kurang teliti dalam penulisan kata.
terimakasih bu
wassalam
By: Kristin Shinta Dewi on 6 November 2013
at 4:05 am
assalamualaikum…
Muhammad Fikri F. 1211208054
bu tentang bahasan energi dengan entalpi, fikri belum terlalu paham mengenai itu. apa perbedaannya, hubungan antara keduanya pun bagaimana.
makasih banyak bu
By: Muhammad Fikri F. on 6 November 2013
at 4:08 am
Assalamualaikum.. Wr.Wb
ibu saya ingin bertanya ,kan setiap gerakan, dipengaruhi oleh banyak faktor dan dapat berubah bentuk saling bertumbukan. yang menyebabkan energi gerakan satu partikel akan berbeda dengan yang lain. apa saja faktor-faktornya ?
By: nisa nursyarifah on 6 November 2013
at 4:10 am
Mohon maaf belum semua komentar ataupun pertanyaannya saya berikan tanggapan atau jawaban, nanti kita diskusikan di kelas
Terimakasih 🙂
By: risars on 6 November 2013
at 9:40 pm